Vollautomatisches Pipettieren von Medien und Reagenzien mit dem System for Live Cell Imaging

Live Cell Imaging Fluidic System (Stage Top® Incubator Type) NEU !!

Dies ist ein vollautomatisches Medium- und Reagenzienpipettiersystem zur Bildgebung von lebenden Zellen.
Es entspricht dem Standard-ANSI / SBS-Footprint und passt in den Stage Top® Incubator.
Sie können problemlos verschiedene Protokolle auf Ihrem PC einrichten, und das System führt den Pipettiervorgang, den sie derzeit manuell ausführen, automatisch durch.
Die Pumpenköpfe und andere medienberührende Teile sind Einwegartikel.
Eigenschaften
- Vom schnellen Mediumwechsel bis zur schonenden Perfusion einfach zu programmieren. Forscher können einfach auf „Start“ drücken, um mit dem vollautomatischen Pipettieren zu beginnen und sich ganz auf die Beobachtung von Zellen zu konzentrieren.
- Ermöglicht eine langsame und präzise Zugabe von Reagenzien (uL/min level), was beim herkömmlichem manuellen Pipettieren schwierig ist. Eine kontrollierte Zufuhrgeschwindigkeit führt zu präzisen Bildern.
- Der Gradientenmodus kann die Konzentration steuern, indem die Durchflussraten der beiden Perfusionspumpen allmählich geändert werden. (Nur für die CEIM-0200-Serie verfügbar)
- Es sind maximal 4 Arten von Reagenzzugabepumpen mit unterschiedlichen Durchflussraten erhältlich. Bitte kontaktieren sie uns für weitere Informationen.
*A certain level of pulsation appears when peristaltic pumps are used.
Spezifikationen
| Modelnummer | CEIM-010x | CEIM-020x |
|---|---|---|
| Medienzuführung/Durchflussrate der Pumpe | 3 ~ 10ml/min | 3 ~ 10ml/min |
| Durchflussrate der Reagenzzugabepumpe | 0.45 ~ 7ml/min | 0.1ul ~ 7ml/min |
| Gradientenmdous | × | ○ |
| Dimensionen | 100 × 240 × 100 mm | 100 × 240 × 100 mm |
| Unterstützt OS | Windows7 und folgende | Windows7 und folgende |
| Angemessener Schalen-Durchmesserr | 35mm | 35mm |
Anwendungsbeispiele
Da der Dosiervorgang die Bildgebung nicht stört, ist es auch bei der Verwendung eines Hochleistungs- / high-NA-Mikroskops (60X, NA 1,35) möglich, die Bilder vor / nach dem Dosieren des Reagenzes klar zu beobachten.
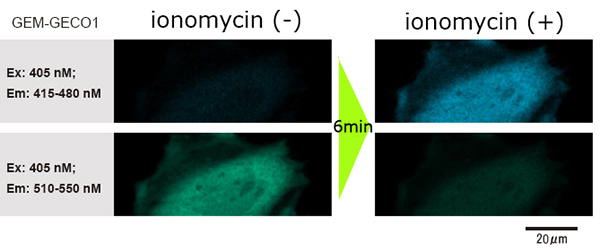
Data courtesy of Dr. H. Shibata and Mr. T. Hayashimoto, Molecular and Cellular Regulation Lab., Graduate School of Bioagricultural Sciences, Nagoya University (Japan)
- Platzieren sie die HeLa-Zellen in die Glasbodenschale und transfizieren sie die Gene.
- Fügen Sie nach einer eintägigen Inkubation 1 ml Reagenz hinzu, um die Gene beim Fotografieren zu stimulieren.
- Die Änderung der Fluoreszenzwellenlänge von GEM-GECO1 innerhalb der Zellen (wenn GEM-GECO1 chemisch an Calciumionen gebunden ist , verschiebt sich die Farbe der Fluoreszenzwellenlänge von grün nach blau) wird beobachtet.
[Experimentelle Bedingungen]
Mikroskop: Invertiertes konfokales Lasermikroskop
Vergrößerung der Objektivlinse: 60x
Numerische Apertur der Objektivlinse: 1.35
Zellen: HeLa cells
Reagenz: ionomycin
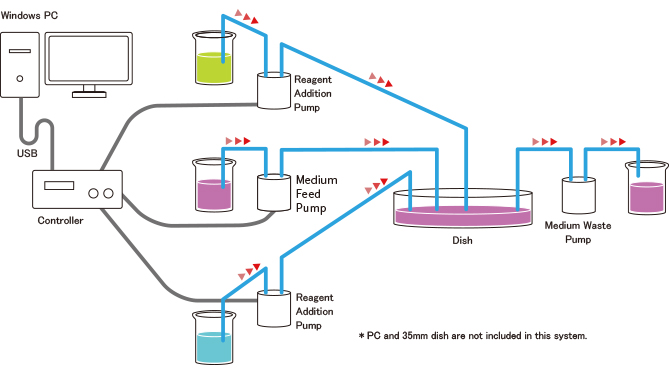
Systemkonfiguration
PC-Einstellung (Beispiel eines Mediumaustauschmodells)
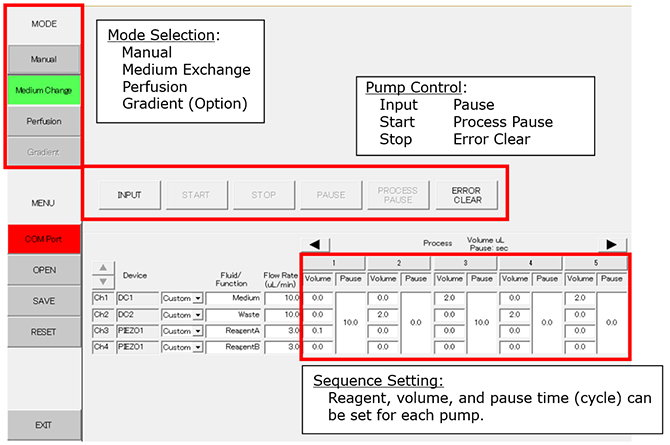
Prozesse unter dieser Einstellung:
Prozess 1: Fügen sie 1ml der Reagenz A zur Schale hinzu. Pausieren sie für 10 Sekunden.
Prozess 2: 2,0ml des Mediums/der Reagenzmischung werden zur Abfallforderung gepumpt
Prozess 3: Geben Sie 2,0 ml neues Medium in die Schüssel. Pausieren sie für 10 Sekunden.
Prozess 4: 2,0ml des Mediums werden zur Abfallförderung gepumpt.
Prozess 5: Fügen Sie 2,0 ml des Mediums zur Schale hinzu.
